Problem komór inhalacyjnych (KI)
Przyjmuje się, że leczenie aerozolami generowanymi z dozowników pMDI wymaga stosowania komór inhalacyjnych (KI). Jak w każdej dziedzinie aerozoloterapii, tak i w przypadku leczenia z wykorzystaniem KI kilka kwestii wymaga analizy i wyjaśnienia w oparciu o racjonalne przesłanki. Z takiej racjonalnej perspektywy niektóre tzw. „kanony” czy „zalecenia” jawią się w odmiennym świetle.
Czemu (a może komu ?) służy priming komór inhalacyjnych?
Priming, czyli „wstępne przygotowanie”, „gruntowanie” komory inhalacyjnej ma teoretycznie pełnić dwie podstawowe role: zwiększać czas połowicznego zaniku aerozolu i poprawiać depozycję płucną leku. Przeanalizujmy kwestię lepszej depozycji leku podawanego z komory inhalacyjnej poddanej primingowi w stosunku do nowej, nie używanej komory inhalacyjnej.
Pierwszy aspekt problemu wymaga zastanowienia się nad związkiem między stopniem ciężkości choroby, depozycją a liczba wykorzystywanych dawek. Można ryzykować następujące uproszczenie:
- ⊚ zła depozycja to ⇒ mniejsza dawka leku, to ⇒ gorszy efekt terapeutyczny ⇒
- ⇒ by wyrównać straty związane z niedoskonałością metody należy podnieść dawkowanie ⇒
- ⇒ skoro nie można podać wyższej dawki w jednej inhalacji należy dawkę ponowić ⇒
- ⇒ dawkowanie 2 x 1 zamiast 1×1 to dwukrotnie szybsze zużycie opakowania ⇒
- ⇒ 2 x szybsze zużycie opakowania to 2 krotnie wyższy zysk dla producenta ⇒
- ⇒ komora inhalacyjna poprawia depozycję, czyli ⇒ podnosi skuteczność leczenia ⇒
- ⇒ przy skutecznym leczeniu można zredukować dawki ⇒ mniejszy zysk wytwórcy ⇒
- ⇒ priming to 10 (± 5) traconych bezpowrotnie dawek ⇒ o co chodzi ??? ⊗
W związku z tym, po drugie należy odpowiedzieć na pytanie, czy prawdą jest, jakoby fabrycznie nowe komory dawały „zerową” depozycję. Twierdzenie takie jest oczywiście fałszywe: nawet fabrycznie nowa komora zwiększa depozycję w stosunku do metod inhalacji wprost z dozownika pMDI o lepszej koordynacji i mniejszych efektach ubocznych nie wspominając. Trzecia kwestia sprowadza się do problemu, czy mowa jest o jednorazowym akcie terapeutycznym, w którym mamy jedną szansę na podanie konkretnej dawki, czy raczej o cyklu powtarzalnych w długim przeciągu czasu kolejnych zabiegów. Okazuje się, że zalecenia terapeutyczne w obszarze np chorób obturacyjnych rozciągają się na tygodnie i miesiące terapii. Z tej perspektywy bardziej istotna wydaje się dawka skumulowana niż dawka jednostkowa wybranego z całego cyklu, pojedynczego zabiegu.

Tab. 1. Masa leku zdeponowana w drogach oddechowych z nowych KI oraz KI poddanych primingowi. Opracowanie: E. Florkiewicz
Przyjmijmy że do „polepszenia ” działania KI należy użyć 15 dawek jako primingu. Pacjent w kolumnie lewej, bez primingu, zużywa 15 x po 0.0 µg leku ale go nie inhaluje, pacjent po stronie prawej leczenie rozpoczyna natychmiast. Dawki podane w tabeli 1 są dawkami zdeponowanymi. Gdyby zalecane dawkowanie opiewało na 2×2 dawki, to już w 4-tym dniu leczenia komora pacjenta z kolumny prawej jest samoistnie „zagruntowana”, a depozycja zrównuje się z depozycją z komory poddanej primingowi. Można mieć wątpliwości, czy mniejsze średnio o ≈ 10% dawkowanie w 1-4 dobie ma wpływ na efekt terapeutyczny, jednak analiza globalnej dawki zdeponowanej, wykorzystanej z pełnego dozownika jasno wskazuje, że jest ona o 11% wyższa bez stosowania primingu w ciągu kolejnych 3 tygodni leczenia.
Czwarty aspekt zagadnienia wymaga odpowiedzi na pytanie, jak błędy związane z primingiem mają się do błędów związanych z innymi aspektami wykorzysatnia komór inhalacyjnych.
Czas półtrwania aerozolu (zanikanie aerozolu)1).
Ciekawe światło na priming rzucają badania tyczące nie depozycji, a czasu półtrwania aerozolu w komorach inhalacyjnych.
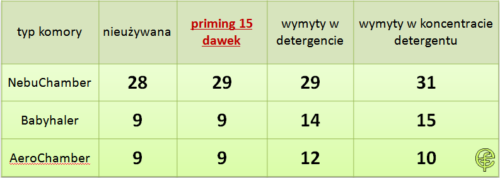
Tab. 2. Czas połowicznego zaniku aerozolu w nowych KI , KI poddanych primingowi oraz KI mytych detergentami 1).
Wielokrotnie w obszarze leczenia inhalacyjnego sytuacja zmusza nas do bardzo daleko idącej konkretyzacji problemu. Podobnie w przypadku KI nie należy stosować uogólnień, przeciwnie, dyskutując o cechach KI należy doprecyzować, o który typ komory inhalacyjnej chodzi nam konkretnie. Jak wynika z danych prezentowanych w tabeli 2 istnieją komory o właściwościach podobnych bez względu na czynniki poboczne (priming, użycie detergentów). Co ciekawe, w niektórych typach KI bardziej efektywnym niż priming sposobem na wydłużenie czasu półtrwania aerozolu jest użycie detergentu. Dyskusja na temat czasu półtrwania aerozolu łączy się bezpośrednio z pytaniem o zalecaną liczbę wdechów wykonywanych z komory inhalacyjnej podczas terapii pMDI.
Ile wdechów prze komorę inhalacyjną ?
Powyższe pytanie jest klasycznym przykładem dylematu typu: którym biegiem trzeba jechać z Gdańska do Zakopanego. Aby racjonalnie odpowiedzieć na to pytanie problem trzeba rozdzielić na dwie kwestie:
- czy aerozol o danym czasie półtrwania będzie nadal obecny przy n-tym wdechu z KI?
- ile aerozolu pozostaje w komorze inhalacyjnej po wykonaniu pierwszego wdechu
Pytanie pierwsze pytanie abstrahuje od faktu poboru aerozolu skupiając się jedynie na izolowanym fenomenie jego zaniku, jednak w pewnych przypadkach może być zasadne a jego analiza może być pouczająca. Drugie pytanie abstrahuje z kolei od objętości oddechowych pacjenta i konkretnej pojemności komory inhalacyjnej.
❶ Czy aerozol o danym czasie półtrwania będzie nadal obecny przy n-tym wdechu z KI?
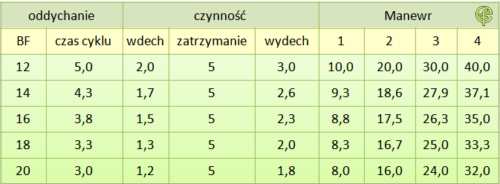
Tab. 3. Czas w sekundach dla cyklu : wdech ⇒ zatrzymanie wdechu ⇒ wydech ⇒ wdech w zależności od BF. Opracowanie: E. Florkiewicz.
W zależności od wieku i stanu czynnościowego dróg oddechowych częstość oddechów jest zróżnicowana. Chory jest w stanie modyfikować tempo oddychania, jednak największy komfort odczuwa w sytuacji, gdy oddycha rytmem spontanicznym. W tabeli 3 przyjęto założenie, że leczenie prowadzone jest w czasie remisji skurczu oskrzeli przy IP%RCT = 40%, czego odzwierciedleniem jest wartość w 3 kolumnie tabeli opisująca czas wdechu w sekundach. Po wdechu, zgodnie z zaleceniami, następuje zatrzymanie oddechu na około 5 sekund, następnie powietrze jest wydychane. Czas trwania wydechu szacowano na 60%RCT. Cztery ostatnie kolumny zawierają dane opisujące czas upływający do końca n-tego cyku: wdech → zatrzymanie wdechu → wydech →wdech. Zestawiając czas półtrwania aerozolu z tabeli 2 z czasem trwania n-cykli można wyrobić sobie opinię, która z komór będzie eliminować aerozol w szybszym, a która w wolniejszym tempie. W przypadku komór „chroniących” aerozol, technikę polegającą na wykonywaniu kilku wdechów po wyzwoleniu jednej dawki z pMDI można uznać za racjonalną, w pozostałych przypadkach priorytetem winno być dążenie do pobrania maksymalnie dostępnej objętości aerozolu za pierwszym wdechem. Pojecie „maksymalnie dostępnej objętości aerozolu” omawiane jest poniżej.
❷ Ile aerozolu pozostaje w komorze inhalacyjnej po wykonaniu pierwszego wdechu.
Zalecając pacjentowi sekwencję: wypuszczenie powietrza zgromadzonego w płucach → wyzwolenie dawki do KI → powolny maksymalny wdech musimy mieć świadomość, że chory realizuje tym samym wymianę objętości powietrza zbliżoną do jego VC. Oszacujmy konsekwencje takiej techniki inhalacji w aspekcie używanej przez chorego komory inhalacyjnej.
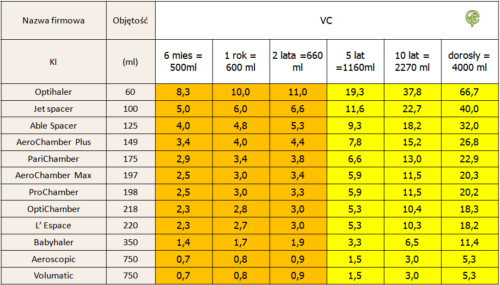
Tab. 4. Krotność objętości KI zagospodarowywana pojemnością płuc pacjenta. Opracowanie: E. Florkiewicz, M.Pirożyński.
Tabela 4 gromadzi dane na temat objętości komór inhalacyjnych oraz szacunkowe, przybliżone pojemności płuc w funkcji wieku. Dane na przecięciu wiersza z pojemnością KI oraz kolumny z pojemnością VC zawierają wartość VC/VKI . Krotność, z jaką pojemność komory inhalacyjnej mieści się w pojemności płuc, daje orientację w zakresie „tempa wypompowywania aerozolu” z KI w trakcie pojedynczego wdechu. Okazuje się, że teoretycznie, w przypadku wdychania objętościami zbliżonymi do VC, nawet niemowlę jest w stanie pobrać pełną objętość aerozolu za pierwszym wdechem. Kluczem jest tutaj słowo „teoretycznie„. Wykonanie zalecenia: wypuszczenie powietrza zgromadzonego w płucach → wyzwolenie dawki do KI → powolny maksymalny wdech wymaga od pacjenta świadomej współpracy z systemem podawania aerozolu. Można dyskutować, w jakim wieku współpraca tak jest możliwa, jednak bezsprzecznie trzeba liczyć się z sytuacją, w której niemowlęta i małe dzieci oddychać będą spontanicznie, wbrew regułom narzucanym przez zalecenia eksperckie.
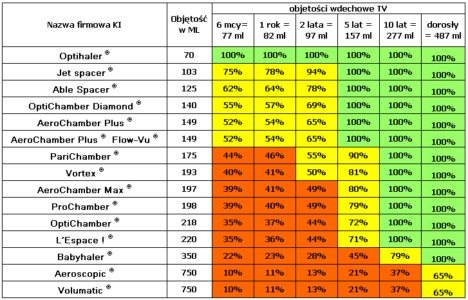
Tab. 5. Procent objętości KI zagospodarowywany objętością oddechową TV pacjenta. Opracowanie: E. Florkiewicz, M.Pirożyński.
Jak wynika z danych zgromadzonych w tabeli 5 reguły gry uległy istotnej zmianie. W przypadku komór wysokoobjętościowych, nawet osoby dorosłe z trudem zbliżają się do możliwości pobrania aerozolu przy 2 wdechach. W stosunku do niemowląt korzystających z komór wysokoobjętościowych, których opróżnienie wymaga minimum 5 a często dopiero 10 wdechów. W takiej sytuacji może rzeczywiście zachodzić konieczność doszacowania strat wynikających z czau połowicznego zaniku aerozolu. Z takiej analizy wypływa prosty wniosek: racjonalne postępowanie wiąże się z zalecanym doborem takiej KI, która poza „ochroną aerozolu” dale szansę na jego pobranie w jednym wdechu (strefa zielona). Dopuszczalne jest stosowanie komór inhalacyjnych dobranych tak, aby cały aerozol można było pobrać w trakcie 2 wdechów (strefa żółta, „ostrzegawcza”). Nie zaleca się stosowania komór inhalacyjnych, których opróżnienie wymagałoby wykonania 3 lub większej liczby wdechów.
1)Berg , J. Madsen, H. Bisgaard In vitro performance of three combinations of spacers and pressurized metered dose inhalers for treatment in children Eur Respir J 1998; 12: 472–476
