Leczenie inhalacyjne wygląda na banalnie proste: wiadomo jakie są zalecane dawki, urządzenia są kolorowe i zaopatrzone w instrukcje obsługi. Z drugiej strony, problematyka związana z leczeniem inhalacyjnym jest rozległa, a istotne dla niej zagadnienia są niekiedy skomplikowane. Ich przyswojenie wymaga często spojrzenia poza horyzont typowy dla medycyny i wykorzystana wiedzy z zakresu nauk ścisłych. Nie wiadomo, czy te właśnie powody: pozorna i powierzchownie traktowana prostota w kontraście ze skomplikowanymi procesami fizycznymi towarzyszącymi inhalacjom są źródłem daleko idących skrótów myślowych, niebezpiecznych uproszczeń i nieuprawnionego spłycania istoty problemów.
WAW jako idol.
Od kilku lat wskaźnik przyspieszenia wdechu funkcjonuje jako argument naukowy w obszarze związanym z poprawnym doborem dozowników DPI do potrzeb pacjenta. Sięgnijmy do artykułu „What the pulmonary specialist should know about the new inhalation therapies1)” dostępnego na stronach European Respiratory Journal.
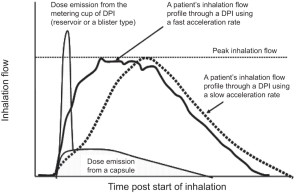
Ryc. 1. Ilustracja w artykule ERS odnosząca się do wskaźnika przyspieszenia wdechu2).
Co widać na rycinie? Oś rzędnych opisana jest wartościami przepływu wdechowego, natomiast oś odciętych jest osią czasu upływającego od początku wdechu. Pozioma linia kropkowana wyznacza granicę szczytowego przepływu wdechowego PIF. Dwie strzałki wskazują na obwiednie wdechu: przesuniętą w lewo, narysowaną linią ciągłą prezentację przepływów przez urządzenie DPI z wysokim wskaźnikiem przyspieszenia wdechu oraz przesuniętą bardziej w prawo, narysowana linia przerywaną obwiednię przepływów przez urządzenie DPI z niskim wskaźnikiem przyspieszenia wdechu. Widoczne są również krzywe obrazujące emisję leku z urządzeń DPI. Bardzo wąska, wysoka, położona skrajnie z lewej strony krzywa, odzwierciedla emisję dawki z komory dozownika rezerwuarowego lub wykorzystującego blistry. Ostatni interesujący nas element stanowi usytuowana najniżej krzywa ilustrująca emisję dawki z dozownika wykorzystującego lek zawarty w kapsułkach. Ilustracji towarzyszy następujący komentarz:
„Superimposed onto the two inhalation profiles in figure 2 are representations of when the dose is emitted from a capsule DPI and from a reservoir- or blister-type DPI. Clearly, the dose is emitted earlier during inhalation from the reservoir- or blister-type DPI, compared with the capsule DPI. For this reason, inhalation volume becomes important for patients using DPIs with capsules, and patients should repeat the inhalation to ensure that they receive the full dose”.
Pomijając niedoskonałości i niuanse tłumaczenia, sens cytowanego fragmentu sprowadza się do opisu znaczenia dwu nałożonych profili wdechowych na sytuacje, w których dawki emitowane są albo z urządzeń DPI, w których lek zgromadzony jest w formie kapsułki, albo z urządzeń, w których lek zgromadzony jest w zasobniku lub blistrze. Dla Autorów jest jasne, że dawka leku wyzwalana jest wcześniej z urządzeń z zasobnikiem leku lub blistrem w porównaniu z DPI wykorzystującymi kapsułki. Z tej przyczyny objętość wdechowa staje się dla pacjentów leczonych dozownikami z kapsułką istotna.
Niestety, tak jak przy nebulizacji, wibroaerozoloterapii czy leczeniu dozownikami pMDI, również wokół terapii dozownikami suchego proszku (DPI) nagromadziło się wiele nieporozumień i zbyt daleko idących uproszczeń. Szczególnym problemem jest sytuacja, w której pewne koncepcje oddzierają do nas za sprawą doniesień publikowanych przez uznane autorytety w źródłach najwyższej rangi. Pozycja autorów i wydawcy jest wówczas tak znacząca, że treści powielane są niemal automatycznie i bezrefleksyjnie. Z takiej perspektywy poszczególne elementy wiedzy medycznej stają się z upływem czasu ideami czy dogmatami, które zaczynamy bardziej „wyznawać” niż „poznawać”. Idolom takim przynależy swego rodzaju „uwielbienie i cześć” , które skutecznie blokują krytyczne myślenie całych pokoleń lekarzy i pacjentów. Na takiej zasadzie w terapii inhalacyjnej funkcjonuje dawka tabelaryczna, na przykład według GINA. Skoro jednak w stosunku do dawek GINA mogły pojawić się pewne uzasadnione wątpliwości być może warto przyjrzeć się krytycznie wiedzy funkcjonującej w obszarze problematyki związanej z leczeniem dozownikami leków proszkowych.
WAW – perpetuum mobile?
Dyskutując o poszczególnych metodach inhalacji w istocie mówimy o sposobie przekształcania leku do postaci aerozolu. Pomimo ewidentnych konotacji z medycyną, aerozoloterapii nie da się opisać racjonalnie bez odwoływania się do fundamentalnych praw fizyki. Lek w postaci roztworu czy proszku nie jest w stanie samoistnie lewitować, eksplodować, czy innym sposobem „sam z siebie” zająć pewną przestrzeń w otaczającym go powietrzu. Nie posiada zmagazynowanej wewnętrznej energii, która byłaby w stanie wytrącić go ze stanu spoczynku (pomijając możliwość zsypywania proszku lub wylewania płynu w wyższego poziomu na niższy, co z aerolizacją leku ma niewiele wspólnego). Do aerolizacji niezbędna jest energia, której nośnikiem przy nebulizacji jest sprężone powietrze, fala ultradźwiękowa czy energia przekazywana na lek z drgającej siatki. W metodzie pMDI energii dostarcza prężność gazu pędnego. W przypadku dozowników DPI jedynym źródłem energii jest przepływające przez urządzenie powietrze, którego ruch wynika wprost z włożonej we wdech siły mięśni pacjenta.
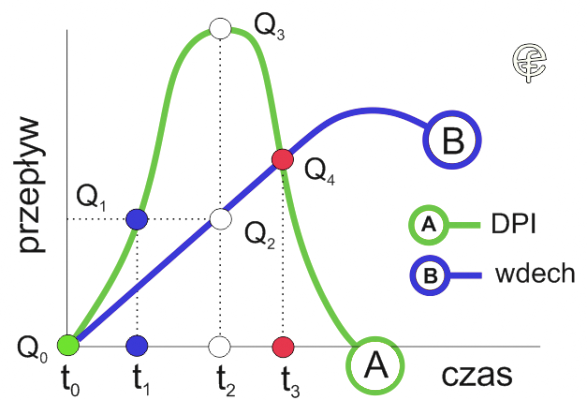
Ryc. 2. Analiza przebiegów czasu i przepływów prezentowanych na rycinie 1.
Rycina druga jest ilustracją tezy zawartej w cytowanym artykule. W momencie t0 nie ma ani przepływu z dozownika DPI (Q0 = 0), ani przepływu wdechowego. Śledzimy zieloną linię A obrazującą przepływy dla „dawki leku wyzwalanej z urządzeń z zasobnikiem leku lub blistrem„. Ku naszemu zaskoczeniu widać, że przepływ leku nastąpił wcześniej, czyli zanim pojawił się przepływ wdychanego powietrza (sic!). W chwili t1 przepływ „wyzwalany z urządzenia z zasobnikiem leku lub blistrem” Q1 jest dwa razy większy niż przepływ powietrza. Dalej, dopiero po upływie czasu od chwili t1 do t2 przepływ wdechowy Q2 osiąga wartość, którą przepływ z urządzenia miał w momencie t1. W tym samym czasie przepływ z dozownika Q3 osiąga swoje maksimum i jest ponad dwukrotnie większy od przepływu wdechowego. Dopiero w momencie t3 przepływ emitowany z urządzenia DPI jest równy przepływowi wdechowemu.
Układ zjawisk i przemian energetycznych, w których element bierny wykonuje pracę bez pobierania energii z zewnątrz lub praca wykonywana przez tenże element jest większa od pobieranej energii znany jest w fizyce jako perpetuum mobile. W modelu proponowanym przez autorów element bierny, czyli rozpraszany lek, zachowuje się dokładnie w taki sposób. Jedyną drogą pogodzenia modelu z prawami fizyki mogłoby być na przykład przyjęcie założenia, że rozpraszany proszek dysponuje energią własną (kapsuła ciśnieniowa, sprężyna, wybuch itp.) wyzwalaną w momencie inicjalizacji rozpraszania leku, co otwiera drogę do dyskusji na temat wykorzystania nie zmienionej koncepcji WAW przy stosowaniu leków pMDI bez komór inhalacyjnych. Tymczasem w przypadku niemal wszystkich leków proszkowych jest oczywiste, że jedynym źródłem energii w układzie są siły związane z przepływem powietrza działające na proszek.
Istnieje również odrębny, topologiczny dowód podważający omawianą koncepcję. W szczelnym układzie, to znaczy w warunkach, kiedy pacjent wdycha powietrze przez urządzenie DPI do układu oddechowego, strumień proszku nie może przemieszczać się na zewnątrz od urządzenia i ciała pacjenta, podobnie nie jest możliwe, by strumień proszku przemieszczał się przez tkanki otaczające drogi oddechowe. Jest oczywiste, że zarówno wdychane powietrze jak też strumień proszku mogą poruszać się wyłącznie w przestrzeni ograniczonej ścianami urządzenia i dróg oddechowych. Mając na względzie, że gaz w obszarze zamkniętym wypełnia go równomiernie okazuje się, że jedyną realną przestrzenią, w której może zachodzić zjawisko przemieszczania się proszku jest strumień wdychanego powietrza. Oznacza to, że obwiednia przepływu wdechowego jest równocześnie „horyzontem zdarzeń” dla leku w postaci proszkowej, innymi słowy nie jest możliwe, by jakiekolwiek zdarzenia tyczące losów leku proszkowego mogły być sytuowane poza obszarem ograniczonym obwiednią cyklu oddechowego.
WAW jako narzędzie.
Przyjęcie opisanych zastrzeżeń niesie istotne konsekwencje dla koncepcji WAW. Okazuje się, że dzięki odmiennej propozycji opisu zdarzeń nie musimy dokonywać przekształceń pośrednich, to jest unikamy porównywania masy leku do objętości zaerolizowaneo proszku a następnie objętości zaerolizowanego proszku do objętości powietrza, ponieważ właśnie ta objętość powietrza determinuje objętość zajmowaną w przestrzeni przez zaerolizowany proszek. Omawiane zagadnienia ilustruje rycina 3.
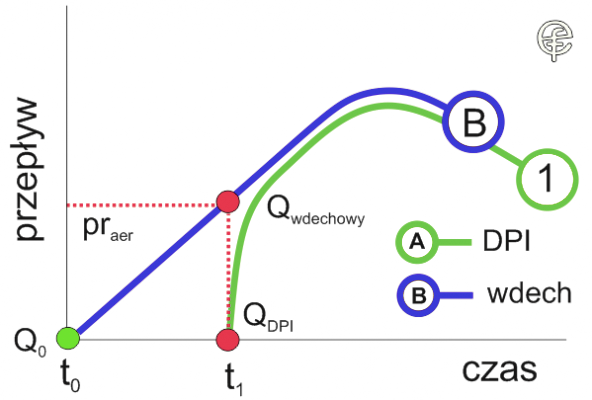
Ryc. 3. Zmodyfikowane założenia teoretyczne wskaźnika akceleracji wdechu.
Schemat przedstawia sytuację, w której w chwili t1 przepływ Qwdechowy osiąga próg aerolizacji praer dla substancji proszkowej zawartej w urządzeniu. Dopiero od tego momentu przepływ QDPI osiąga wartość wyższą od zera i zaczyna rosnąć. Rodzi to kolejny problem w odniesieniu konsekwentnego i zgodnego z rzeczywistością sposobu prezentacji danych.Wiadomo, że pole pod krzywą przepływ –czas jest graficzną ilustracją zmian objętości opisanych tymi zmiennymi. Przyjmijmy założenia, że: WAW pacjenta = 2L/s2 a cechy dozownika DPI opisuje wartość progu aerolizacji = 30 L/min i wartość czasu potrzebnego do aerolizacji leku = 0,3 sek.
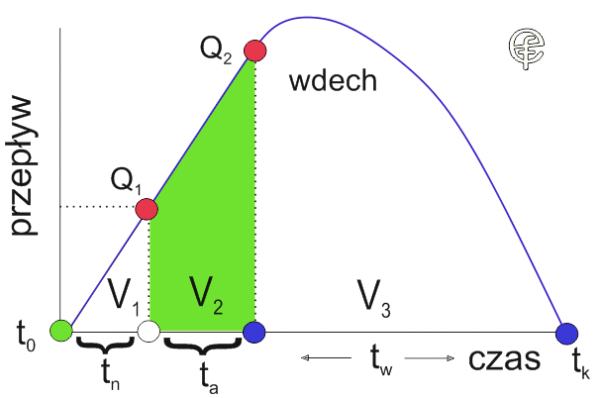
Ryc. 4. Konsekwencje zastosowania wskaźnika akceleracji wdechu w układzie przepływ – czas.
W pierwszym kroku wyliczamy czas do osiągnięcia progu tpra.
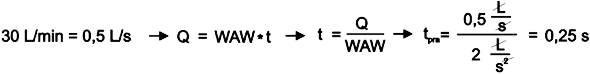
Wyniósł on 0,25 sekundy. Obliczmy teraz, jaka objętość powietrza przeszła przez urządzenie w czasie tn , nieefektywnym dla aerolizacji.
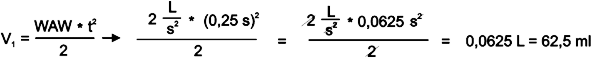
Zatem dopiero po zainhalowaniu 62,5 ml powietrza rozpoczęła się aerolizacja leku. Wiemy, że trwała ona 0,3 sekundy. Ciekawe, jaki był przepływ na końcu aerolizacji ?
Jak widać wartość 1,1 L/sek jest niższa niż szczytowy przepływ wdechowy PIF. Może to oznaczać, że wartość PIF może być traktowana fakultatywnie pod warunkiem, że obligatoryjnie dysponujemy danymi opisującymi pró aerozlizacji. Jaka objętość przeszła przez dozownik DPI do chwili zakończenia aerolizacji”

Wystarczy teraz odjąć od niej objętość nieefektywną by uzyskać objętość wygenerowanego aerozolu : 302,5 ml – 62,5 ml = 240 ml. Wykonane przykłady obliczeń z wykorzystaniem wskaźnika WAW rodzą pewne konsekwencje.
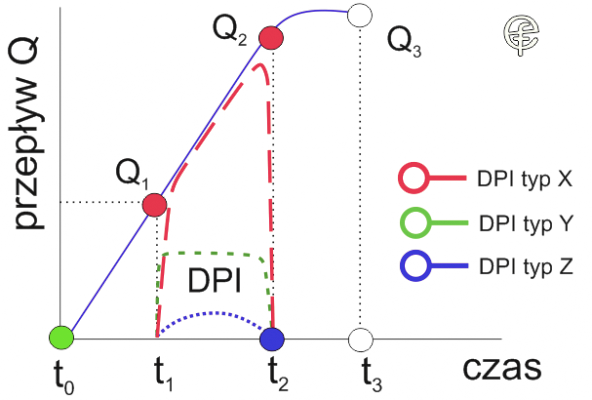
Ryc. 5. Objętość aerolizowanego leku w układzie przepływ – czas.
Pamiętamy, że z jednej strony jedyną realną przestrzenią, w której może zachodzić zjawisko przemieszczania się proszku, jest strumień wdychanego powietrza a obwiednia przepływu wdechowego jest równocześnie „horyzontem zdarzeń” dla leku w postaci proszkowej, oraz z drugiej strony, że pole pod krzywą w układzie przepływ/czas reprezentuje objętość. Dla 3 hipotetycznych przepływów z urządzeń DPI, oznaczonych jako X, Y i Z oraz przepływu wdechowego, między czasem t1 a t2 kreślone są pojawiające się wówczas objętości. Przyjęcie na wiarę, że grafika na ryc. 1, 2 i 3 jest dokładnym odzwierciedleniem rzeczywistości wiąże się automatycznie z koniecznością zaakceptowania faktu, że objętość aerolizowanego proszku z dozownika typu X na ryc. 5 zbliża się do 240 ml, co jak wiadomo nie może być prawdą. Bardziej racjonalny jest przebieg krzywej przepływu proszku dla dozownika DPI typu Y a najbliższy rzeczywistości kształt krzywej dla dozownika Z.
Rodzi się w tym momencie pytanie, czy wiedza taka jest w ogóle do jakiegoś istotnego celu potrzebna? Okazuje się bowiem, że bez względu na fabularyzowany w celach dydaktycznych profil uwalniania masy leku w jednostce czasu, w ostatecznym efekcie cała masa leku (która jest znana nie dzięki analizie pola pod krzywą ale dzięki podanej przez producenta dawce emitowanej) zawarta jest w objętości powietrza pobranej między początkiem aerolizacji w momencie t2 a jej końcem w momencie t2. Możliwe jest wprawdzie uszczegółowienie modelu o analizę fluktuacji gęstości cząstek leku w strumieniu powietrza, jednak nadal model taki nie łamie zasady, że aerolizowana masa leku zawarta jest w objętości powietrza pobieranej między momentem t1 i t2.
WAW w trakcie przepływu powietrza przez DPI.
W praktyce klinicznej, przy stwierdzeniu obturacji, wykonanie farmakologicznej próby rozkurczowej służy ocenie różnic w przebiegu dwóch obwiedni oraz różnic między parami wartości parametrów liczbowych, co pozwala na poznanie efektu działania zastosowanego leku. Istnieje ewidentna dysproporcja między warsztatem diagnostycznym służącym ocenie przepływów wydechowych, a możliwościami badania zdolności wykonania efektywnego wdechu. Wachlarz typowych parametrów fazy wydechowej reprezentują: PEF, MEF75, MEF50, MEF25, FEF75/85, FEF25/75. Dla porównania, parametry przepływów w fazie wdechowej oceniane są za pomocą: PIF oraz MIF50. Istota problemu polega jednak na sytuacji, w której dysponujemy wprawdzie możliwością spirometrycznej obserwacji zjawisk zachodzących przy forsownym oddychaniu przed zastosowaniem leku i po zastosowaniu leku, natomiast nie ma możliwości zbadania parametrów wdechowych w trakcie inhalowania substancji leczniczej. Należy mieć świadomość, że zastosowanie jakiegokolwiek urządzenia inhalacyjnego, a w szczególności inhalatorów suchego proszku (DPI), nieuchronnie interferuje z przepływani wdechowymi.
W warunkach codziennej praktyki lekarskiej znane są standardowe procedury pomiaru siły wdechu z zastosowanym oporem (np. InCheck®). Uzyskiwana w ich wyniku wartość szczytowego przepływu wdechowego (PIF) nie pozwala na wnioskowanie o kształcie obwiedni, ponadto pomiar taki nie jest w stanie wskazać momentu pojawienia się PIF w kontekście FVCIN i upływu czasu. Kluczową niekonsekwencją metod pomiaru spirometrycznego i InCheck® w stosunku do metodologii rejestracji leków proszkowych jest posługiwanie się wartościami przepływów powietrza w abstrakcji od gradientu ciśnień stanowiących ich źródło. W związku z powyższym poszukiwano sposobu nie tylko na bardziej precyzyjny sposób rejestrowania zjawisk zachodzących w fazie wdechowej, lecz również umożliwiający odniesienie ich do standardowego gradientu 4 kPa, zdefiniowanego w Farmakopei Europejskiej 2004.
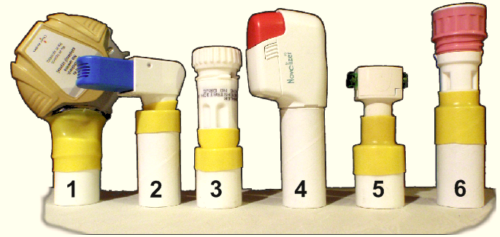
Ryc. 6. Sześć typowych na polskim rynku dozowników DPI przystosowanych do pomiaru ciśnienia wdechowego.
Sprawdzono możliwości zastosowania metody pomiaru ciśnienia w czasie rzeczywistym dla kilku popularnych inhaltorów DPI. W tym celu łączono plastikowy ustnik z ustnikiem testowanego urządzenia przy wykorzystaniu materiału termokurczliwego (1,2,3,5,6). Urządzenie 4 pasowało szczelnie do ustnika bez konieczności dodatkowych zabiegów. Urządzenie 1 wymagało zastosowania dodatkowego uszczelnienia na połączeniu materiału termokurczliwego i ustnika DPI.
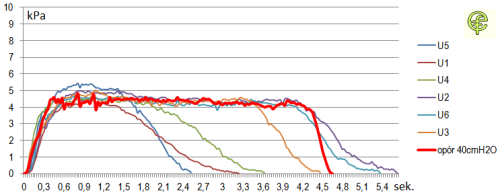
Ryc. 7. Zapis pomiaru ciśnienia wdechowego przy wdechu przez 6 popularnych dozowników DPI.
Na rycinie powyżej zaprezentowano wynik nałożenia obwiedni ciśnień pojawiających się w czasie wdechu przez wykorzystane do badania dozowniki DPI. Po stronie lewej zilustrowano próbę dokonywania wdechu z siłą porównywalną do tej, jaka jest niezbędna do pokonania oporu 40 cm H2O (ok. 4 kPa). Zapis rejestrowany był przy wdechu dokonywanym z siłą maksymalną do osiągnięcia przez osobę badaną. Możliwe jest wykazanie różnic w rozkładzie ciśnień, kształcie obwiedni oraz czasie trwania forsownego wdechu. Przy ciśnieniach porównywalnych z 4 kPa urządzenia U5, U1 i w mniejszym stopniu U4 cechuje półokrągły kształt obwiedni, natomiast dla urządzeń U3, U6 a w szczególności U2 obserwowana jest wyraźna faza plateau.
1)B.L. Laube, H.M. Janssens, F.H.C. de Jongh, S.G. Devadason, R. Dhand, P. Diot, M.L. Everard, I. Horvath, P. Navalesi, T. Voshaar, H. Chrystyn DOI: 10.1183/09031936.00166410 Published 1 June 2011
2)UWAGA: Do dnia 07 marca 2016 r. obraz był pobierany jest bezpośrednio z adresu :
http://d39mdc1iz3oyyf.cloudfront.net/content/erj/37/6/1308/F2.large.jpg?download=true. Po wdrożeniu ochrony protokołem ![]() strona korzysta z kopii obrazu zamieszczonej na bezpiecznym serwerze.
strona korzysta z kopii obrazu zamieszczonej na bezpiecznym serwerze.
